首頁(yè)> 行業(yè)資訊
- 行業(yè)資訊
- “大咖”齊聚嘉定,,共話醫(yī)療器械新趨勢(shì)
- “中國(guó)智造”助力全球醫(yī)療設(shè)備行業(yè)創(chuàng)新(國(guó)際視點(diǎn))
- 許偉:我國(guó)醫(yī)療器械產(chǎn)業(yè)規(guī)模突破萬(wàn)億元,,年均復(fù)合增長(zhǎng)率超10%
- 美瞳產(chǎn)品屬第三類醫(yī)療器械不能隨便賣
- 懷化市市場(chǎng)監(jiān)管局開(kāi)展醫(yī)療器械經(jīng)營(yíng)使用單位飛行檢查
- 港股異動(dòng)|醫(yī)療器械股走高 醫(yī)保預(yù)付金有望推動(dòng)企業(yè)回款加速 創(chuàng)新器械將迎新放量空間
- 四川出臺(tái)實(shí)施方案 全鏈條促進(jìn)醫(yī)療器械創(chuàng)新發(fā)展
- 泰山區(qū)醫(yī)藥及醫(yī)療器械產(chǎn)業(yè)鏈赴蘇州開(kāi)展招商引資
- 康拓醫(yī)療:取得個(gè)性化聚醚醚酮顱骨缺損修復(fù)假體醫(yī)療器械注冊(cè)證
- 陜西藥品和醫(yī)療器械產(chǎn)業(yè)發(fā)展“連級(jí)跳”
國(guó)家藥監(jiān)局公布,,進(jìn)口醫(yī)療器械最新消息
時(shí)間:2020-09-28 09:13:08
醫(yī)藥網(wǎng)9月27日訊 9月25日消息,,國(guó)家藥監(jiān)局對(duì)外發(fā)布《關(guān)于進(jìn)口醫(yī)療器械產(chǎn)品在中國(guó)境內(nèi)企業(yè)生產(chǎn)有關(guān)事項(xiàng)的公告(2020年 第104號(hào))》,。
《關(guān)于進(jìn)口醫(yī)療器械產(chǎn)品在中國(guó)境內(nèi)企業(yè)生產(chǎn)有關(guān)事項(xiàng)的公告(2020年 第104號(hào))》
為進(jìn)一步貫徹落實(shí)國(guó)務(wù)院《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見(jiàn)》和中共中央辦公廳,、國(guó)務(wù)院辦公廳印發(fā)的《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見(jiàn)》,落實(shí)“放管服”改革和優(yōu)化營(yíng)商環(huán)境要求,,全面深化醫(yī)療器械審評(píng)審批制度改革,,推動(dòng)醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展,更好地滿足公眾健康需求,,現(xiàn)就已獲進(jìn)口醫(yī)療器械注冊(cè)證產(chǎn)品在中國(guó)境內(nèi)企業(yè)生產(chǎn)的有關(guān)事項(xiàng)公告如下:
一,、適用范圍
進(jìn)口醫(yī)療器械注冊(cè)人通過(guò)其在境內(nèi)設(shè)立的外商投資企業(yè)在境內(nèi)生產(chǎn)第二類、第三類已獲進(jìn)口醫(yī)療器械注冊(cè)證產(chǎn)品的有關(guān)事項(xiàng),,適用本公告,。
二、注冊(cè)要求
(一)進(jìn)口醫(yī)療器械注冊(cè)人在中國(guó)境內(nèi)設(shè)立的外商投資企業(yè)作為注冊(cè)申請(qǐng)人,,向藥品監(jiān)督管理部門(mén)提交境內(nèi)醫(yī)療器械注冊(cè)申請(qǐng),。注冊(cè)申請(qǐng)內(nèi)容,除注冊(cè)人名稱,、住所,、生產(chǎn)地址外,原則上應(yīng)當(dāng)與所對(duì)應(yīng)的進(jìn)口醫(yī)療器械注冊(cè)證及其附件載明的相關(guān)事項(xiàng)保持一致,。
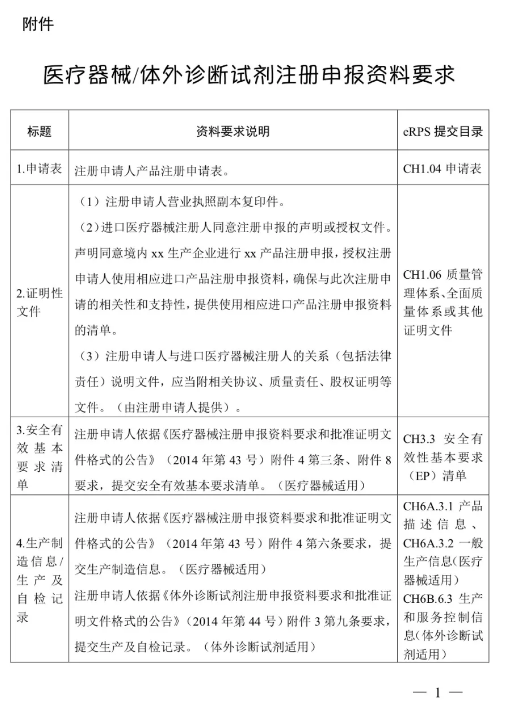
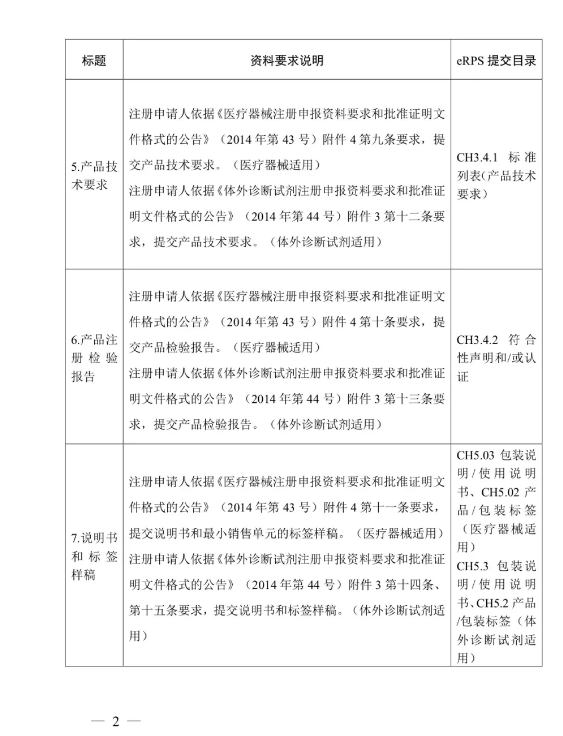
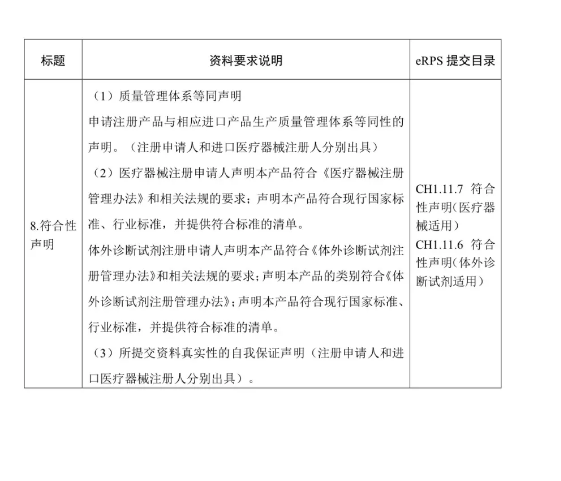
(二)注冊(cè)申請(qǐng)人按照《醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》(國(guó)家食品藥品監(jiān)督管理總局2014年第43號(hào)公告),、《體外診斷試劑注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》(國(guó)家食品藥品監(jiān)督管理總局2014年第44號(hào)公告)等要求提交注冊(cè)申報(bào)資料。其中,,醫(yī)療器械產(chǎn)品的綜述資料,、研究資料、臨床評(píng)價(jià)資料,、產(chǎn)品風(fēng)險(xiǎn)分析資料,,體外診斷試劑產(chǎn)品的綜述資料、主要原材料的研究資料(適用時(shí)),、主要生產(chǎn)工藝及反應(yīng)體系的研究資料(適用時(shí)),、分析性能評(píng)估資料、陽(yáng)性判斷值或參考區(qū)間確定資料,、穩(wěn)定性研究資料,、臨床評(píng)價(jià)資料,、產(chǎn)品風(fēng)險(xiǎn)分析資料,可提交進(jìn)口醫(yī)療器械的原注冊(cè)申報(bào)資料,。進(jìn)口注冊(cè)人和境內(nèi)注冊(cè)申請(qǐng)人應(yīng)當(dāng)確保上述資料與本次注冊(cè)申請(qǐng)的相關(guān)性和支持性,。
(三)注冊(cè)申報(bào)程序按照《醫(yī)療器械注冊(cè)管理辦法》《體外診斷試劑注冊(cè)管理辦法》以及醫(yī)療器械電子申報(bào)相關(guān)規(guī)定執(zhí)行。
(四)按照本公告要求提交注冊(cè)申請(qǐng)并獲得批準(zhǔn)的,,注冊(cè)證備注欄中應(yīng)當(dāng)載明相關(guān)已獲準(zhǔn)注冊(cè)的進(jìn)口產(chǎn)品的醫(yī)療器械注冊(cè)證號(hào),。
三、注冊(cè)體系核查要求
注冊(cè)申請(qǐng)人應(yīng)當(dāng)確保境內(nèi)生產(chǎn)包含產(chǎn)品的主要生產(chǎn)工藝,,并承諾主要原材料和生產(chǎn)工藝不發(fā)生改變,,提供產(chǎn)品在境內(nèi)生產(chǎn)質(zhì)量管理體系符合我國(guó)《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》的自查報(bào)告和境內(nèi)外質(zhì)量管理體系等同性對(duì)比報(bào)告。藥品監(jiān)管部門(mén)按照醫(yī)療器械注冊(cè)質(zhì)量管理體系核查工作程序,,對(duì)境內(nèi)注冊(cè)申請(qǐng)人開(kāi)展全面核查,,重點(diǎn)關(guān)注境內(nèi)外質(zhì)量管理體系的等同性、溯源性,,以及變更生產(chǎn)過(guò)程帶來(lái)的體系變化是否會(huì)產(chǎn)生新的風(fēng)險(xiǎn),,引起注冊(cè)事項(xiàng)的變更。
四,、上市后監(jiān)管要求
境內(nèi)注冊(cè)人應(yīng)當(dāng)按照《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》辦理醫(yī)療器械生產(chǎn)許可證,,嚴(yán)格落實(shí)質(zhì)量安全主體責(zé)任,加強(qiáng)醫(yī)療器械全生命周期質(zhì)量管理,;按照《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》要求,,建立健全質(zhì)量管理體系并保證有效運(yùn)行。
五,、其他方面
中國(guó)境內(nèi)企業(yè)投資的境外注冊(cè)人在境內(nèi)生產(chǎn)已獲進(jìn)口醫(yī)療器械注冊(cè)證的第二類,、第三類醫(yī)療器械產(chǎn)品的,參照本公告執(zhí)行,,由投資境外注冊(cè)人的中國(guó)境內(nèi)企業(yè)作為注冊(cè)申請(qǐng)人申請(qǐng)?jiān)摦a(chǎn)品注冊(cè),。
香港、澳門(mén),、臺(tái)灣地區(qū)已獲醫(yī)療器械注冊(cè)證的產(chǎn)品有關(guān)事項(xiàng)參照本公告執(zhí)行。
本公告自公告之日起施行,。
附件:醫(yī)療器械/體外診斷試劑注冊(cè)申報(bào)資料要求
國(guó)家藥監(jiān)局
2020年9月18日
附件:醫(yī)療器械/體外診斷試劑注冊(cè)申報(bào)資料要求