首頁> 行業(yè)資訊
- 行業(yè)資訊
- 積極應(yīng)變,醫(yī)療器械上市公司發(fā)聲
- 藥監(jiān)局推動高端醫(yī)療器械發(fā)展 醫(yī)療AI等有望加速,三大細分環(huán)節(jié)率先受益,!
- 近300款硬核科技集結(jié)2025CMEF!魚躍以“AI+醫(yī)療”開啟健康管理新紀元
- 醫(yī)療器械更安全,!川渝推出穩(wěn)健設(shè)計指南 從源頭保障產(chǎn)品質(zhì)量
- 審管聯(lián)動“聯(lián)彈協(xié)奏曲”!新泰兩部門合筑醫(yī)療器械安全“閉環(huán)鏈”
- 中關(guān)村探“新”:智能醫(yī)療裝備開啟健康新紀元
- 東南亞醫(yī)療市場新機遇:6月tHIS ASEAN登陸馬來西亞,,聚焦前沿醫(yī)療技術(shù)與創(chuàng)新
- 中關(guān)村醫(yī)療器械成果轉(zhuǎn)化平臺已儲備200余個項目
- 新賽道上搶先機——省藥監(jiān)局培育發(fā)展藥,、械新質(zhì)生產(chǎn)力觀察
- 一次性使用壓力監(jiān)測射頻消融導(dǎo)管創(chuàng)新產(chǎn)品獲批上市
國家藥監(jiān)局公布,,進口醫(yī)療器械最新消息
時間:2020-09-28 09:13:08
醫(yī)藥網(wǎng)9月27日訊 9月25日消息,國家藥監(jiān)局對外發(fā)布《關(guān)于進口醫(yī)療器械產(chǎn)品在中國境內(nèi)企業(yè)生產(chǎn)有關(guān)事項的公告(2020年 第104號)》,。
《關(guān)于進口醫(yī)療器械產(chǎn)品在中國境內(nèi)企業(yè)生產(chǎn)有關(guān)事項的公告(2020年 第104號)》
為進一步貫徹落實國務(wù)院《關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》和中共中央辦公廳,、國務(wù)院辦公廳印發(fā)的《關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》,落實“放管服”改革和優(yōu)化營商環(huán)境要求,,全面深化醫(yī)療器械審評審批制度改革,,推動醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展,更好地滿足公眾健康需求,,現(xiàn)就已獲進口醫(yī)療器械注冊證產(chǎn)品在中國境內(nèi)企業(yè)生產(chǎn)的有關(guān)事項公告如下:
一,、適用范圍
進口醫(yī)療器械注冊人通過其在境內(nèi)設(shè)立的外商投資企業(yè)在境內(nèi)生產(chǎn)第二類、第三類已獲進口醫(yī)療器械注冊證產(chǎn)品的有關(guān)事項,,適用本公告,。
二、注冊要求
(一)進口醫(yī)療器械注冊人在中國境內(nèi)設(shè)立的外商投資企業(yè)作為注冊申請人,,向藥品監(jiān)督管理部門提交境內(nèi)醫(yī)療器械注冊申請,。注冊申請內(nèi)容,,除注冊人名稱,、住所、生產(chǎn)地址外,,原則上應(yīng)當(dāng)與所對應(yīng)的進口醫(yī)療器械注冊證及其附件載明的相關(guān)事項保持一致,。
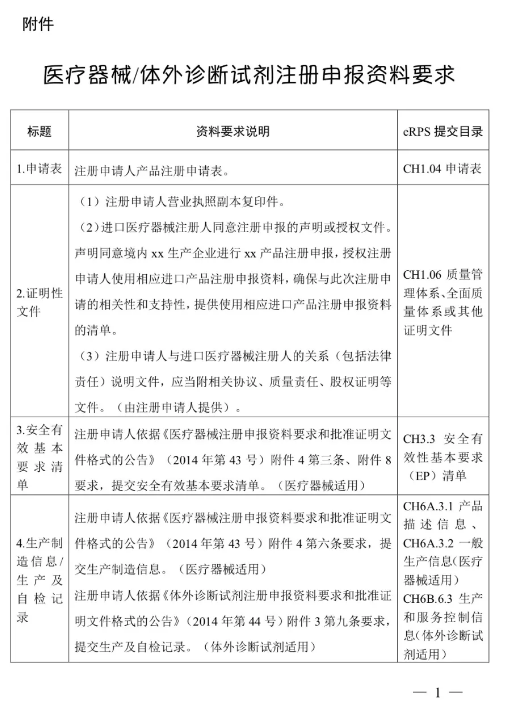
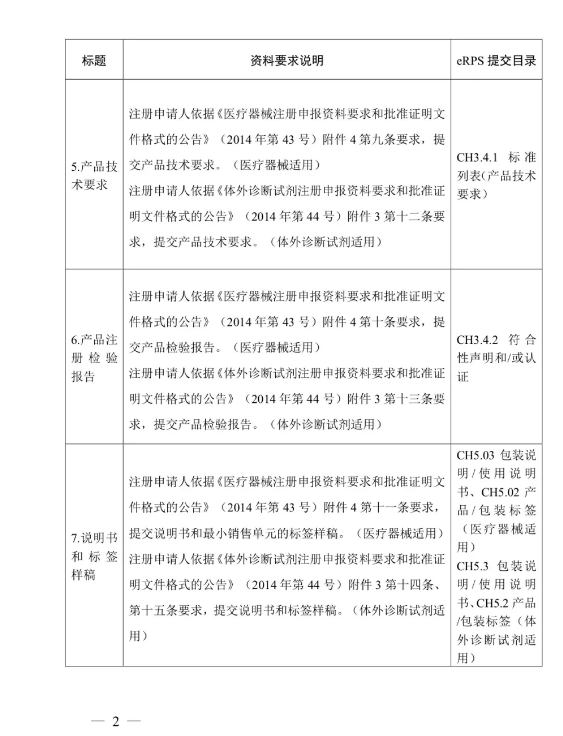
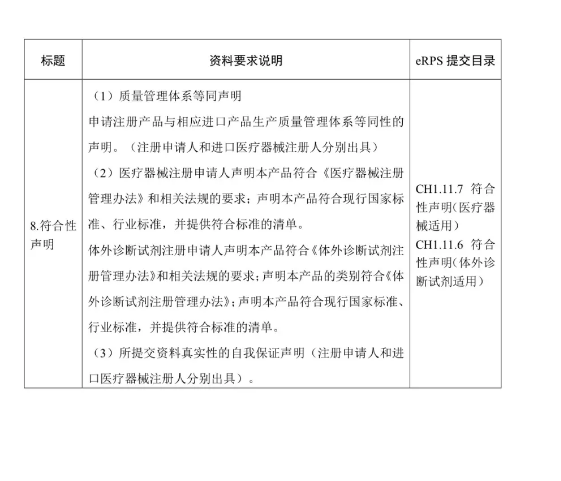
(二)注冊申請人按照《醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(國家食品藥品監(jiān)督管理總局2014年第43號公告)、《體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(國家食品藥品監(jiān)督管理總局2014年第44號公告)等要求提交注冊申報資料,。其中,,醫(yī)療器械產(chǎn)品的綜述資料、研究資料,、臨床評價資料,、產(chǎn)品風(fēng)險分析資料,體外診斷試劑產(chǎn)品的綜述資料,、主要原材料的研究資料(適用時),、主要生產(chǎn)工藝及反應(yīng)體系的研究資料(適用時)、分析性能評估資料,、陽性判斷值或參考區(qū)間確定資料,、穩(wěn)定性研究資料,、臨床評價資料、產(chǎn)品風(fēng)險分析資料,,可提交進口醫(yī)療器械的原注冊申報資料,。進口注冊人和境內(nèi)注冊申請人應(yīng)當(dāng)確保上述資料與本次注冊申請的相關(guān)性和支持性。
(三)注冊申報程序按照《醫(yī)療器械注冊管理辦法》《體外診斷試劑注冊管理辦法》以及醫(yī)療器械電子申報相關(guān)規(guī)定執(zhí)行,。
(四)按照本公告要求提交注冊申請并獲得批準的,,注冊證備注欄中應(yīng)當(dāng)載明相關(guān)已獲準注冊的進口產(chǎn)品的醫(yī)療器械注冊證號。
三,、注冊體系核查要求
注冊申請人應(yīng)當(dāng)確保境內(nèi)生產(chǎn)包含產(chǎn)品的主要生產(chǎn)工藝,,并承諾主要原材料和生產(chǎn)工藝不發(fā)生改變,提供產(chǎn)品在境內(nèi)生產(chǎn)質(zhì)量管理體系符合我國《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》的自查報告和境內(nèi)外質(zhì)量管理體系等同性對比報告,。藥品監(jiān)管部門按照醫(yī)療器械注冊質(zhì)量管理體系核查工作程序,,對境內(nèi)注冊申請人開展全面核查,重點關(guān)注境內(nèi)外質(zhì)量管理體系的等同性,、溯源性,,以及變更生產(chǎn)過程帶來的體系變化是否會產(chǎn)生新的風(fēng)險,引起注冊事項的變更,。
四,、上市后監(jiān)管要求
境內(nèi)注冊人應(yīng)當(dāng)按照《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》辦理醫(yī)療器械生產(chǎn)許可證,嚴格落實質(zhì)量安全主體責(zé)任,,加強醫(yī)療器械全生命周期質(zhì)量管理,;按照《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》要求,建立健全質(zhì)量管理體系并保證有效運行,。
五,、其他方面
中國境內(nèi)企業(yè)投資的境外注冊人在境內(nèi)生產(chǎn)已獲進口醫(yī)療器械注冊證的第二類、第三類醫(yī)療器械產(chǎn)品的,,參照本公告執(zhí)行,,由投資境外注冊人的中國境內(nèi)企業(yè)作為注冊申請人申請該產(chǎn)品注冊。
香港,、澳門,、臺灣地區(qū)已獲醫(yī)療器械注冊證的產(chǎn)品有關(guān)事項參照本公告執(zhí)行。
本公告自公告之日起施行,。
附件:醫(yī)療器械/體外診斷試劑注冊申報資料要求
國家藥監(jiān)局
2020年9月18日
附件:醫(yī)療器械/體外診斷試劑注冊申報資料要求